Skandium, se symbolem prvku Sc a atomovým číslem 21, je snadno rozpustný ve vodě, může reagovat s horkou vodou a snadno tmavne na vzduchu. Jeho hlavní valence je +3. Často se mísí s gadoliniem, erbiem a dalšími prvky, s nízkým výtěžkem a obsahem přibližně 0,0005 % v kůře. Skandium se často používá k výrobě speciálního skla a lehkých vysokoteplotních slitin.
V současné době dosahují prokázané světové zásoby skandia pouze 2 miliony tun, z nichž 90–95 % tvoří bauxitové, fosforitové a železo-titanové rudy a malá část uranové, thoriové, wolframové a vzácné zeminové rudy, které se nacházejí především v Rusku, Číně, Tádžikistánu, Madagaskaru, Norsku a dalších zemích. Čína je velmi bohatá na zdroje skandia a má obrovské zásoby nerostů souvisejících se skandiem. Podle neúplných statistik dosahují zásoby skandia v Číně přibližně 600 000 tun, které se nacházejí v ložiskách bauxitu a fosforitu, ložiscích wolframu s porfyrem a křemenem v jižní Číně, ložiskách vzácných zemin v jižní Číně, ložisku železné rudy vzácných zemin Bayan Obo ve Vnitřním Mongolsku a ložisku vanadu a titanu magnetitu Panzhihua v provincii S'-čchuan.
Vzhledem k nedostatku skandia je jeho cena také velmi vysoká a na svém vrcholu byla desetinásobkem ceny zlata. Přestože cena skandia klesla, stále je čtyřnásobkem ceny zlata!
Objevování historie
V roce 1869 si Mendělejev všiml rozdílu v atomové hmotnosti mezi vápníkem (40) a titanem (48) a předpověděl, že zde existuje také neobjevená atomová hmotnost jednoho prvku s přechodnou hmotností. Předpověděl, že jeho oxidem je X ₂ O Å. Skandium objevil v roce 1879 Lars Frederik Nilson z Uppsalské univerzity ve Švédsku. Vytěžil ho z dolu na černé vzácné zlato, komplexní rudy, která obsahuje 8 druhů oxidů kovů. VytěžilOxid erbia(III)z černé vzácné zlaté rudy a získanéOxid ytterbia(III)z tohoto oxidu a existuje další oxid lehčího prvku, jehož spektrum ukazuje, že se jedná o neznámý kov. Toto je kov předpovězený Mendělejevem, jehož oxid jeSc₂O₃Samotný kovový skandium byl vyroben zChlorid skandiaelektrolytickým tavením v roce 1937.
Mendělejev
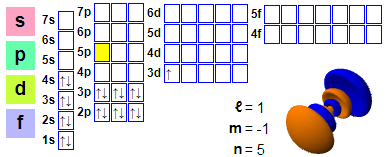
Elektronová konfigurace
Elektronová konfigurace: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Skandium je měkký, stříbrnobílý přechodný kov s bodem tání 1541 °C a bodem varu 2831 °C.
Po značnou dobu po jeho objevení nebylo použití skandia prokázáno kvůli jeho obtížné výrobě. S rostoucím zdokonalováním metod separace prvků vzácných zemin nyní existuje vyspělý proces čištění sloučenin skandia. Protože skandium je méně alkalické než yttrium a lanthanoidy, je hydroxid nejslabší, takže směsný minerál prvků vzácných zemin obsahující skandium se oddělí od prvku vzácných zemin metodou „stupňovitého srážení“, kdy se hydroxid skandia(III) po převedení do roztoku zpracuje amoniakem. Druhou metodou je oddělení dusičnanu skandia polárním rozkladem dusičnanu. Protože se dusičnan skandia rozkládá nejsnadněji, lze skandium oddělit. Kromě toho je důležitým zdrojem skandia také komplexní získávání doprovodného skandia z ložisek uranu, thoria, wolframu, cínu a dalších minerálů.
Po získání čisté sloučeniny skandia se tato převede na ScCl₃ Å a roztaví se společně s KCl a LiCl. Roztavený zinek se používá jako katoda pro elektrolýzu, což způsobuje vysrážení skandia na zinkové elektrodě. Poté se zinek odpaří, čímž se získá kovové skandium. Jedná se o lehký stříbrnobílý kov s velmi aktivními chemickými vlastnostmi, který může reagovat s horkou vodou za vzniku vodíku. Kovové skandium, které vidíte na obrázku, je tedy uzavřeno v lahvi a chráněno argonovým plynem, jinak skandium rychle vytvoří tmavě žlutou nebo šedou oxidovou vrstvu a ztratí svůj lesklý kovový lesk.
Aplikace
Osvětlovací průmysl
Využití skandia se soustředí ve velmi jasných směrech a není přehnané ho nazvat Synem světla. První magickou zbraní skandia je skandium-sodíková výbojka, která může osvětlit tisíce domácností. Jedná se o halogenidovou elektrickou lampu: žárovka je naplněna jodidem sodným a trijodidem skandia a současně se přidávají skandium a sodíková fólie. Během vysokonapěťového výboje emitují ionty skandia a ionty sodíku světlo o svých charakteristických emisních vlnových délkách. Spektrální čáry sodíku jsou 589,0 a 589,6 nm, dvě slavná žlutá světla, zatímco spektrální čáry skandia jsou 361,3~424,7 nm, což je řada emisí blízkého ultrafialového a modrého světla. Protože se vzájemně doplňují, celková barva produkovaného světla je bílá. Právě proto, že se skandium-sodíkové výbojky vyznačují vysokou světelnou účinností, dobrou barvou světla, úsporou energie, dlouhou životností a silnou schopností rozptylu mlhy, mohou být široce používány pro televizní kamery, náměstí, sportovní areály a osvětlení pouličních prostor a jsou známé jako světelné zdroje třetí generace. V Číně se tento typ výbojek postupně prosazuje jako nová technologie, zatímco v některých rozvinutých zemích se tento typ výbojek široce používal již na začátku 80. let 20. století.
Druhou magickou zbraní skandia jsou solární fotovoltaické články, které dokáží shromažďovat světlo rozptýlené na zemi a přeměňovat ho na elektřinu pro pohon lidské společnosti. Skandium je nejlepším bariérovým kovem v kovových izolancích, polovodičových křemíkových solárních článcích a solárních článcích.
Jeho třetí magická zbraň se nazývá zdroj γ A záření. Tato magická zbraň dokáže jasně zářit sama o sobě, ale tento druh světla nelze vnímat pouhým okem, jedná se o tok fotonů o vysoké energii. 45Sc obvykle extrahujeme z minerálů, což jsou jediné přírodní izotopy skandia. Každé jádro 45Sc obsahuje 21 protonů a 24 neutronů. 46Sc, umělý radioaktivní izotop, lze použít jako zdroj γ záření nebo stopovací atomy, které lze také použít k radioterapii maligních nádorů. Existují také aplikace, jako je yttrium-galium-skandium-granátový laser.Fluorid skandiaSkleněné infračervené optické vlákno a katodová trubice potažená skandiem v televizi. Zdá se, že skandium se rodí s jasem.
Průmysl slitin
Skandium ve své elementární formě se široce používá k dopování hliníkových slitin. Jakmile se do hliníku přidá několik tisícin skandia, vytvoří se nová fáze Al3Sc, která bude hrát v hliníkové slitině metamorfózu a výrazně změní strukturu a vlastnosti slitiny. Přidání 0,2 % až 0,4 % Sc (což je velmi podobné poměru přidávání soli do domácí restované zeleniny, stačí jen malé množství) může zvýšit teplotu rekrystalizace slitiny o 150–200 °C a výrazně zlepšit pevnost za vysokých teplot, strukturální stabilitu, svařovací vlastnosti a odolnost proti korozi. Může také zabránit jevu křehnutí, ke kterému snadno dochází při dlouhodobé práci za vysokých teplot. Vysokopevnostní a houževnatější hliníkové slitiny, nové vysokopevnostní korozivzdorné svařitelné hliníkové slitiny, nové vysokoteplotní hliníkové slitiny, vysokopevnostní hliníkové slitiny odolné neutronovému záření atd. mají velmi atraktivní perspektivy rozvoje v leteckém průmyslu, letectví, lodích, jaderných reaktorech, lehkých vozidlech a vysokorychlostních vlacích.
Skandium je také vynikajícím modifikátorem železa a malé množství skandia může výrazně zlepšit pevnost a tvrdost litiny. Kromě toho lze skandium použít i jako přísadu do vysokoteplotních slitin wolframu a chromu. Samozřejmě, kromě výroby svatebních oděvů pro ostatní má skandium vysoký bod tání a jeho hustota je podobná hliníku a používá se také ve vysokoteplotních lehkých slitinách, jako je skandium-titanová slitina a skandium-hořčíková slitina. Vzhledem ke své vysoké ceně se však obecně používá pouze ve špičkových výrobních odvětvích, jako jsou raketoplány a rakety.
Keramický materiál
Skandium, samostatná látka, se obecně používá ve slitinách a jeho oxidy hrají důležitou roli v keramických materiálech podobným způsobem. Tetragonální zirkoničitý keramický materiál, který lze použít jako elektrodový materiál pro palivové články na bázi tuhého oxidu, má jedinečnou vlastnost, kdy se vodivost tohoto elektrolytu zvyšuje se zvyšující se teplotou a koncentrací kyslíku v prostředí. Krystalová struktura tohoto keramického materiálu však sama o sobě nemůže existovat stabilně a nemá žádnou průmyslovou hodnotu; pro zachování původních vlastností je nutné dopovat některé látky, které mohou tuto strukturu fixovat. Přidání 6~10% oxidu skandia působí jako betonová struktura, takže zirkoničitý lze stabilizovat na čtvercové mřížce.
Existují také technické keramické materiály, jako je vysokopevnostní a teplotně odolný nitrid křemíku, jako zhušťovadla a stabilizátory.
Jako zhušťovadlo,Oxid skandiaNa okraji jemných částic může tvořit žáruvzdornou fázi Sc2Si2O7, čímž snižuje deformaci technické keramiky za vysokých teplot. Ve srovnání s jinými oxidy může lépe zlepšit mechanické vlastnosti nitridu křemíku za vysokých teplot.
Katalytická chemie
V chemickém inženýrství se skandium často používá jako katalyzátor, zatímco Sc2O3 lze použít k dehydrataci a deoxidaci ethanolu nebo isopropanolu, rozkladu kyseliny octové a výrobě ethylenu z CO a H2. Katalyzátor Pt-Al obsahující Sc2O3 je také důležitým katalyzátorem pro hydrogenaci těžkého oleje, čištění a rafinaci v petrochemickém průmyslu. V katalytických krakovacích reakcích, jako je kumen, je aktivita zeolitového katalyzátoru Sc-Y 1000krát vyšší než aktivita hlinitokřemičitanového katalyzátoru; ve srovnání s některými tradičními katalyzátory budou vyhlídky na vývoj skandiových katalyzátorů velmi slibné.
Jaderný energetický průmysl
Přidání malého množství Sc2O3 k UO2 ve vysokoteplotním jaderném palivu reaktoru může zabránit mřížkové transformaci, zvětšení objemu a praskání způsobenému přeměnou UO2 na U3O8.
Palivový článek
Podobně přidání 2,5 % až 25 % skandia do nikl-alkalických baterií prodlouží jejich životnost.
Zemědělský chov
V zemědělství lze semena, jako je kukuřice, řepa, hrách, pšenice a slunečnice, ošetřit síranem skandium (koncentrace je obvykle 10⁻³ až 10⁻⁶ mol/l, různé rostliny se budou lišit) a skutečný účinek podpory klíčení byl dosažen. Po 8 hodinách se suchá hmotnost kořenů a pupenů zvýšila o 37 %, respektive o 78 % ve srovnání se sazenicemi, ale mechanismus je stále předmětem studia.
Od Nielsenovy pozornosti k datům o atomové hmotnosti až do současnosti se skandium dostalo do povědomí lidí teprve sto nebo dvacet let, ale téměř sto let sedělo na lavičce. Až energický rozvoj materiálové vědy na konci minulého století mu vnesl vitalitu. Dnes se prvky vzácných zemin, včetně skandia, staly žhavými hvězdami v materiálové vědě, hrají neustále se měnící roli v tisících systémů, každý den nám přinášejí větší pohodlí a vytvářejí ekonomickou hodnotu, kterou je ještě obtížněji měřit.
Čas zveřejnění: 29. června 2023