Cer je nesporným „velkým bratrem“ ve velké rodině prvků vzácných zemin. Zaprvé, celkové zastoupení vzácných zemin v zemské kůře je 238 ppm, přičemž cer obsahuje 68 ppm, což představuje 28 % celkového složení vzácných zemin a je na prvním místě. Zadruhé, cer je druhým prvkem vzácných zemin objeveným devět let po objevu yttria (1794). Jeho použití je velmi rozsáhlé a „cer“ je nezastavitelný.
Objev prvku ceru

Carl Auer von Welsbach
Cer objevili a pojmenovali v roce 1803 Němec Kloppers, švédský chemik Jöns Jakob Berzelius a švédský mineralog Wilhelm Hisinger. Nazývá se cerium a jeho ruda se nazývá cerit na památku Ceres, asteroidu objeveného v roce 1801. Ve skutečnosti je tento typ křemičitanu ceričitého hydratovaná sůl obsahující 66 % až 70 % ceru, zatímco zbytek tvoří sloučeniny vápníku, železa a...yttrium.
Prvním využitím ceru byl plynový krb, který vynalezl rakouský chemik Carl Auer von Welsbach. V roce 1885 se pokusil o směs hořčíku, lanthanu a oxidu yttritého, ale tyto směsi bez úspěchu vyzařovaly zelené světlo.
V roce 1891 zjistil, že čistý oxid thoria produkuje lepší světlo, ačkoli je modré, a smícháním s oxidem ceričitým vzniká jasné bílé světlo. Oxid ceričitý lze navíc použít také jako katalyzátor pro spalování oxidu thoria.
Cer kov

★ Cer je tvárný a měkký stříbrnobílý kov s aktivními vlastnostmi. Na vzduchu oxiduje a vytváří rzi podobnou odlupující se oxidovou vrstvu. Při zahřátí hoří a rychle reaguje s vodou. Vzorek kovového ceru o velikosti centimetru zcela zkoroduje přibližně do jednoho roku. Zabraňte kontaktu se vzduchem, silnými oxidačními činidly, silnými kyselinami a halogeny.
★ Cer se vyskytuje hlavně v monazitu a bastnaezitu, stejně jako ve štěpných produktech uranu, thoria a plutonia. Je škodlivý pro životní prostředí, zvláštní pozornost je třeba věnovat znečištění vodních toků.
★ Cer je 26. nejhojnější prvek, který tvoří 68 ppm zemské kůry, druhý hned po mědi (68 ppm). Cer je hojnější než běžné kovy, jako je olovo (13 ppm) a cín (2,1 ppm).
Konfigurace ceriových elektronů
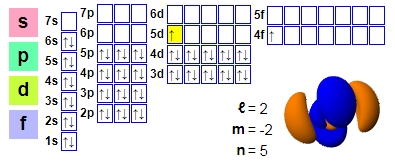
Elektronická ujednání:
1s² 2s² 2p6 3s² 3p6 4s² 3d10 4p6 5s² 4d10 5p66s² 4f1 5d1
★ Cer se nachází za lanthanem a má 4f elektrony začínající od ceru, což mu usnadňuje účast v chemických reakcích. 5d orbital ceru je však obsazený a tento efekt není u ceru dostatečně silný.
★ Většina lanthanoidů může jako valenční elektrony použít pouze tři elektrony, s výjimkou ceru, který má proměnlivou elektronovou strukturu. Energie 4f elektronů je téměř stejná jako energie externích 5d a 6s elektronů delokalizovaných v kovovém stavu a ke změně relativního obsazení těchto elektronových energetických hladin je potřeba jen malé množství energie, což vede k dvojité valenci +3 a +4. Normální stav je valence +3, což v anaerobní vodě vykazuje valenci +4.
Aplikace ceru

★ Lze použít jako přísadu do slitin a pro výrobu solí ceru atd.
★ Může být použit jako přísada do skla pro absorpci ultrafialového a infračerveného záření a je široce používán v automobilovém skle.
★ Lze jej použít jako vynikající materiál na ochranu životního prostředí a v současné době je nejreprezentativnějším katalyzátorem pro čištění výfukových plynů automobilů, který účinně zabraňuje vypouštění velkého množství výfukových plynů automobilů do ovzduší.
★ Světloprvky vzácných zeminsložené převážně z ceru jako regulátory růstu rostlin mohou zlepšit kvalitu plodin, zvýšit výnos a zvýšit odolnost plodin vůči stresu.
★ Sulfid ceričitý může nahradit kovy, jako je olovo a kadmium, které jsou škodlivé pro životní prostředí a lidi, v pigmentech, může barvit plasty a lze jej také použít v průmyslu nátěrů a inkoustů.
★Oxid ceričitýlze použít jako lešticí pastu, například při chemicko-mechanickém leštění (CMP).
★ Cer lze také použít jako materiály pro ukládání vodíku, termoelektrické materiály, cer-wolframové elektrody, keramické kondenzátory, piezoelektrickou keramiku, cer-karbid křemíku abrazivní materiály, suroviny pro palivové články, benzínové katalyzátory, permanentní magnetické materiály, lékařské materiály, různé legované oceli a neželezné kovy.
Čas zveřejnění: 3. července 2023